2018.1.31. KERC 멘토 한남식
1 바이오 신약 개발
- 현황
- 바이오신약개발단계는 여러 단계로 구성됨
- 순수과학적 연구를 통한 신약개발후보물질 선정에서부터 임상을 거쳐 FDA승인 및 출시에 이르기까지 여러 단계를 거쳐야 함
- 연구개발에 소요되는 평균 기간은 최소 10년 임
- 연구개발에 소요되는 평균 비용은 지속적으로 상승하고 있음
- 1979년 대비 2015년 40배 가량 급상승한 미화 38억 달러 (한화 4조원 가량)에 이르게 됨[1]
- 1979: 1억 달러, 1991년 3억 달러, 2000년 8억 달러, 2010년 23억 달러
- 바이오신약개발단계는 여러 단계로 구성됨
- 난관
- 장기간에 걸친 고비용 투자
- 천문학적 비용이 소요되고 10여년에 걸리는 장기간 개발기간이 소요됨
- 매우 저조한 성공률
- 최종 FDA승인을 받아 출시될때 까지 매우 저조한 성공률을 보임
- 특히 1990년대 보다 성공률은 더욱 낮아지고 있음
- 1990년대 성공률과 2000년대 성공률 비교[2]
- 장기간에 걸친 고비용 투자
| 임상1상 | 임상2상 | 임상3상 | 임상4상 | 출시 | |
| 1990년대 | 69% | 46% | 66% | 86% | 18% |
| 2000년대 | 59% | 28% | 56% | 93% | 9% |
- 실패 요인 분석 [1]
- 주요 실패 원인은 과학적 연구와 영향이 깊음 (76%)
- 신약물의 효능 문제 (52%), 부작용 문제 (24%)
- 특히 과반을 상회하는 실패률의 요인인 신약물의 효능 문제 [2]
- 가장 주요 원인은 해당 신약물과 특정된 질병간 효능을 증명할 연관 관계가 증명되지 않거나 이를 검증할 모델 자체가 존재하지 않음 (40%)
- 그 외로는 약물 투여량이 해당 신약물의 특성상 제한적일 수 밖에 없어 효능이 없는 경우 (29%), 전임상단계로 가기 위한 최소한의 효능 검증 안됨 (20%)
- 다른 실패 요인들로는 전략이나 마케팅적 문제에 기인함 (24%)
- 전략상 문제 (15%) , 사업성 문제 (6%), 운영상 문제 (3%)
- 주요 실패 원인은 과학적 연구와 영향이 깊음 (76%)
- 대안
- 연구개발 비용과 시간 단축
- 인공지능을 포함한 다양한 컴퓨터공학적 기법들을 활용
- 신약개발후보물질 발굴 정확도 향상 및 기간 단축
- 비용 급증하는 임상단계 전에 정확하고 충분한 검증으로 실패를 미연에 방지
- 대용량 바이오메이컬데이터 활용
- 이미 유전체 및 후성유전체 연구를 신약개발연구에 활용하고 있음
- 특히 유전자 변이에 기인한 질병발생 원인을 파악해 신약표적 발굴에 활용
- 성공률 제고
- 표적 발굴 및 조기 검증 정확성 향상
- 인공지능 및 가상검증시스템 등 컴퓨터공학기법을 활용해 정확도 향상
- 급증하는 바이오메디컬데이터를 활용하여 정밀의학 기법 도입
- 실패비용이 상대적으로 매우 낮은 초기단계에서 정확히 성공률을 예측
- 지속적 신약표적물질 검증
- 기존에는 주로 선도화합물의 발굴이나 구조최적화 단계까지만 수행
- 최소 임상 2상까지 지속적으로 수행할 필요성 대두
- 실패비용이 기하급수적으로 상승되는 후반부에서의 실패를 미연에 방지
- 정밀의학을 활용한 약물 효능 개선
- 맞춤형 약물 개발
- 동일 질병을 보유한 환자군 전체를 특이한 유전정보를 바탕으로 구별함
- 구별된 각 환자군 별 대표적인 바이오마커 이용함
- 바이오마커를 기준으로 환자군 별로 맞춤형 약물 개발
- 맞춤형 약물 투여
- 환자별 개인 유전정보 분석을 통하여 주요 바이오마커들 확인
- 바이오마커들의 유무에 따른 투여할 약물의 종류를 결정함
- 또한 투여하기로 결정된 약물의 투여량 또한 환자별로 정확히 조절함
- 맞춤형 약물 개발
- 표적 발굴 및 조기 검증 정확성 향상
- 인공지능을 포함한 다양한 컴퓨터공학적 기법들을 활용
- 연구개발 비용과 시간 단축
2 인공지능과 바이오신약개발
- 인공지능 일반론
- 개념
- 인공지능은 컴퓨터공학의 한 분야로써 컴퓨터가 대용량 데이터를 학습하여 스스로 의사결정을 하거나 예측을 하는 등 인간 수준의 지능을 갖추는 것을 의미함
- 인공지능이란 단어는 최근 들어 크게 각광을 받고 있으나 이미 1960년대 부터 존재해온 개념으로 주로 기계학습/머신러닝 (Machine Learning) 혹은 딥러닝 (Deep Learning)을 통칭함
- 최근 들어 인공지능에 대해 관심이 급증되는 요인에는 다음 두가지가 있음
- 다양한 분야에서 소위 빅데이터로 통칭되는 대용량 데이터들이 생산되고 저장되고 있지만 실제로 가장 요구되는 유용한 정보를 빅데이터를 분석하여 찾아내지 못하는 난관에 봉착하고 있음
- 근래 컴퓨터 하드웨어의 급속한 발전으로 빅데이터를 저장하고 관리할 수 있게 되었을 뿐 아니라 대용량 연산이 가능하게 되어 복잡한 구조로 설계된 인공지능 시스템의 구현이 가능해 짐
- 인공지능 분야의 발전
- Google DeepMind사의 AlphaGo 시리즈
- 바둑을 두는 컴퓨터 인공지능인 AlphaGO는 바둑 세계 쳄피언에게 승리
- 초기 버전의 AlphaGo를 개선시킨 AlphaGo Zero는 더 정확하고 더 빠른 성능을 보임
- 앞선 두 버전은 인간 바둑기사들이 바둑을 두었던 기보들을 데이터로 이용하여 매우 많은 학습 단계를 거쳤음
- 이제는 Alpha Zero라는 새로운 방식의 인공지능이 개발됨
- Alpha Zero는 기보를 데이터로 받아들여 학습을 하지 않음
- Alpha Zero는 바둑을 두는 기본적 규칙만을 학습한 후 혼자 바둑을 계속하여 두면서 바둑을 두어 상대를 이기는 방법을 터득하게 됨
- 이는 곳 바둑이라는 특정한 게임에 국한되지 않고 매우 다양한 분야에 범용으로 활용될 수 있음을 의미함
- 실제로 Alpha Zero는 바둑 이외의 다른 게임들에도 적용되어 매우 놀라울 정도의 속도로 승률을 개선시킴
- IMB사의 Watson
- Watson은 다양한 메시징 플랫폼의 가상 에이전트인 챗봇과 같은 대화 서비스, 언어 분석을 하여 내용과 핵심 키워드를 분석하는 서비스 등을 제공
- 또한 이미지 분석 및 인식 에도 널리 활용되고 있음
- 최근에는 의학분야에 적용되어 암을 판별하는 역할을 하며 인간 의사들에게 조언을 제공함
- Google DeepMind사의 AlphaGo 시리즈
- 개념
- 바이오신약개발분야에 있어 인공지능 연구비 투자동향
- 헬스케어와 신약개발분야에서 인공지능을 활용한 연구에 투자된 횟수와 액수가 모두 획기적으로 증가함[3]
- 2012년: 투자건 26건, 투자액 9천4백만불
- 2016년: 투자건 173건 (7배 증가), 투자액 13억2천7백만불 (14배 증가)
- 단기간에 획기적으로 증가한 이유
- 인공지능 분야의 발전에 따른 대한 관심도 급증
- Google DeepMind사의 AlphaGo 시리즈
- IMB사의 Watson
- 바이오메디컬 분야 데이터 생산량의 비약적 급증
- 인간유전체 시퀀싱 기술의 비약적 발전
- 차세대염기서열분석기법(Next generation sequencing)의 발전
- 염기서열분석의 초기 버전이라 할 수 있는 생어시퀀싱 (Sanger Sequencing)과 달리 DNA조각을 병렬로 시퀀싱함으로써 더 빠르게 더 충분한 정확도로 유전체 전체를 시퀀싱 할 수 있음
- 그래서 High-throughput sequencing, Massive parallel sequencing 또는 Second-generation sequencing이라고도 불림
- 이 기법은 분자생물학에서 가장 중요하다고 여기는 대부분의 생명현상을 유전체 상에서 관찰할 수 있는 다양한 기회를 제공하는 큰 장점이 있음
- 이에 따라 다양한 생명현상을 관찰한 결과물이 대용량으로 생성됨
- 최근에는 시퀀싱 비용 역시 빠른 속도로 저렴해져 더 많은 시퀀싱이 전세계적으로 실험되고 있어 더 많은 시퀀싱 데이터가 축적되고 있음
- Human Genome Project(HGP) 와 ENCODE Project
- 앞선 시퀀싱 기법을 활용해 인간유전체를 시퀀싱 하여 데이터베이스화 하는 다국적 프로젝트가 Human Genome Project로 10여년간 진행되어 2002년 완료됨
- 이 프로젝트는 분자생물학 분야에 비약적 발전을 가져다 주었고, 그로 인해 유전체 시퀀싱 기술 역시 비약적 발전을 가져오게 되는 계기가 됨
- 또한 Post-HGP 시대가 열리게 함으로써 ENCODE Project와 같은 시퀀싱 결과물들로 부터 유의미한 정보를 부여하고 찾아내는 다양한 분석 프로젝트들이 시작되게 하는 시발점이 됨
- 데이터 저장기술과 컴퓨터 연산기술 및 비용의 급감
- Moore's 법칙에 의해 비용의 하락이 급격히 이루어지고 있음
- 데이터 저장의 비용은 비화 1달러 당 1 만개 트랜지스터 수준
- 컴퓨터 연산의 비용은 미화 1달러 당 1 gigabyte 수준
- 유럽 학계 기관들 중 가장 큰 데이터베이스를 보유하고 있는 EMBL-EBI (European Molecular Biology Laboratory - European Bioinformatics Institute)는 2014년 25 petabyte의 데이터를 저장하고 있었으나 1년만인 2015년에는 60 petabyte (~120,000 데이터셋)에 이르는 급상승세를 보이고 있음 (참고로 1 petabyte = 1,000,000 gigabyte)
- Moore's 법칙에 의해 비용의 하락이 급격히 이루어지고 있음
- 차세대염기서열분석기법(Next generation sequencing)의 발전
- 인간유전체 시퀀싱 기술의 비약적 발전
- 인공지능 분야의 발전에 따른 대한 관심도 급증
- 헬스케어와 신약개발분야에서 인공지능을 활용한 연구에 투자된 횟수와 액수가 모두 획기적으로 증가함[3]
- 바이오신약개발분야에 있어 인공지능 활용
- 신약개발연구분야 이외 타 분야들에 있어 인공지능에 대한 공통사항
- 대용량 데이터 생산해내는 비용이 저렴한 편임
- 학습용 데이터는 예측될 결과치와 매우 유사함
- 학습용 데이터의 특징이 비교적 명확히 파악됨
- 예외적 요소가 발생할 경우가 없는 매우 잘 통제된 환경임
- 신약개발연구분야만을 위한 인공지능에서 고려되어야 할 사항
- 데이터 생산에 소요되는 비용이 상대적으로 매우 비쌈
- 타 분야 평균 비용 20불
- 바이오메디컬 분야 평균 비용 1만불
- 데이터의 규모가 상대적으로 작은 편이어서 기계학습에 충분치 않음
- 데이터에서 유의미한 정보의 비율이 극심히 적은편임
- 바이오메디컬 데이터들은 매우 noise가 심하고 biased되어 있음
- 예를 들어 High throughput screen 데이터의 경우1%의 compound만이 활성화되어 있음
- 그렇기 때문에 대부분의 경우에 이러한 학습되지 않은 영역까지 추론에 의해 학습모델이 확장되어 가야만 함
- 생물학적 혹은 생화학적 현상들에 대한 전반적인 충분한 이해도가 현저히 낮은 상황에서 모델이 수립되고 적용되어야 함
- 바이오메디컬 데이터가 담고있는 정보인 생물학적 작용이나 현상은 일개 분자에서 발생된 변이가 세포와 조직을 넘어 생명 전반에 영향을 줄 정도로 파급력이 넓음
- 그렇기 때문에 생물학 데이터에 적용되어야할 AI는 반드시 해당 생물학적 도메인에 맞춤형으로 세밀하게 설계되어 적용되어야만 함
- 데이터 생산에 소요되는 비용이 상대적으로 매우 비쌈
- 신약개발연구분야 이외 타 분야들에 있어 인공지능에 대한 공통사항
- 바이오신약개발분야에 있어 인공지능을 위한 데이터 공유
- 데이터 공유가 중요한 이유
- 신약개발을 하는 제약회사들 대부분은 컴퓨터 인공지능을 이용한 혁신적 방법론이 신약개발연구에 적용될 수 있으리라 기대하고 있음
- 그러나 인공지능이 신약개발연구에 적용되기 위해서는 반드시 선행되어야할 사항들이 존재함
- 인공지능에서 데이터의 중요성
- 데이터를 학습을 통해 인공지능 구현
- 인공지능은 컴퓨터공학분야에서 Machine Learning이라 불리는 기계학습에서 기원함
- 용어에서 설명되는 그대로 기계인 Computer를 학습시켜 기계가 홀로 직접 주어진 상황에 대해 사고 또는 결정을 내리는 것을 말함
- 이렇게 사고를 하고 결정을 내리는 것은 전적으로 학습을 통해 체계적으로 축적된 지능에 기반함
- 그렇기 때문에 학습을 시키는 과정이 매우 중요함
- 학습의 성공 여부는 데이터의 양과 질에 의존
- 학습을 시키는 과정은 데이터의 양과 질에 전적으로 좌우됨
- 그렇기 때문에 가능한 최고 수준의 좋은 양질의 데이터를 가능한 많이 준비하여 기계를 학습시켜야 함
- 현재로서는 신약개발연구분야 뿐 아니라 의생명공학분야 전반에 걸쳐 여기에 가장 큰 어려움이 있음 (의생명공학분야 전반에 걸쳐 데이터 준비에 어려운 점들은 앞서 이미 언급함)
- 해결책
- 현재 해결책으로 제시되고 있는 것은 데이터 공유(data sharing) 임
- 산-학-연 공동연구를 통해 각 기관들이 자신들의 데이터를 공동연구기관들과 공유함으로써 보다 양질의 데이터를 더 대량으로 마련할 수 있음
- 데이터를 학습을 통해 인공지능 구현
- 데이터 공유가 중요한 이유
- 인공지능을 신약개발연구에 적용할 경우 유의사항
- 기존의 컴퓨터공학적 방법론
- 이미 1970년대 부터 컴퓨터공학적 방법론을 신약개발연구에 이용하기 위한 시도는 지속되어 왔음
- 가령 Computer-Aided Drug Design (CADD)와 같은 방법론은 drug design 분야에서는 매우 보편적으로 사용되어 오고 있음
- 인공지능 역시 컴퓨터공학의 한 분야이기 때문에 기존까지 사용해 왔던 다른 컴퓨터공학적 방법론처럼 여겨지거나 이용하려는 경향이 지배적임
- 인공지능과 다른 방법론들과의 차이점
- 기존의 컴퓨터공학적 방법론들은 주로 설계나 시각화에 도움을 줌
- 예를 들면 앞서 언급한 CADD는 연구자들이 머릿속에서 구상한 모델을 실제로 보여질 수 있도록 컴퓨터를 이용해 설계도면처럼 그려내는 방법임
- 그러나 인공지능은 단순히 인간인 연구자들이 구상한 모델만을 구현 시켜주는 것이 아님
- CADD보다 매우 다양하고 많은 양의 데이터를 학습하여 보다 정교하고 복잡한 모델을 컴퓨터가 홀로 추론해 낼 수 있음
- 그렇다 보니 CADD 처럼 인간 연구자들로 부터의 지적 입력이 결정적 데이터 이지도 않고 의존적이지도 않음
- 오히려 연구자들로 부터의 사전 입력이나 통제는 최소한일 수록 좋은 경향이 분명함
- 유의사항
- 인공지능 방법론을 활용할 경우 반드시 특정한 방향으로 치우쳐 있는 사항들은 배제시켜야 함
- 즉 CADD와 같은 기존의 컴퓨터 방법론들을 적용하고 이용하는 방식으로 인공지능을 신약개발연구에 이용하는 것은 인공지능의 효율성과 활용도를 극심히 제약시킬 수 있음
- 기존의 컴퓨터공학적 방법론들은 주로 설계나 시각화에 도움을 줌
- 기존의 컴퓨터공학적 방법론
- 바이오신약개발분야에 있어 인공지능의 장점과 단점
- 인공지능의 장점
- 인공지능은 시스템화 하여 대규모로 이용될 수 있어 다양한 각도에서 평가 할 수 있음
- 공동연구를 할 경우 다른 공동연구기관에서 기 수행된 인공지능을 활용한 연구를 그대로 재현할 수 있음
- 새로운 데이터가 입수된다면 즉시 컴퓨터 인공지능 알고리즘을 학습시키는 과정에 추가하여 더 개선된 인공지능을 만들 수 있음
- 인공지능은 신약개발연구에 연계된 대부분의 분야들에 접목 가능함
- 가령 화학, 생물학, 역학, 병리학, 심리학 등
- 인공지능의 단점
- 인공지능 모델들은 여전히 매우 잘 훈련 받고 숙련된 전문가들만이 설계하고 구현할 수 있음
- 데이터에 대한 의존도가 매우 높음
- 컴퓨터를 학습시키는 단계에서는 그 주어진 해당 분야의 문제점을 매우 정밀하고 특정하고 있는 데이터를 이용해야만 함
- 그렇기 때문에 개개의 인공지능 모델 아직까지는 상당히 세부적인 특정 분야에만 한정되어 사용될 수 있음
- 인공지능 모델들은 여전히 일종의 블랙박스와 같이 내부의 작동원리를 이해 할 수 없는 경우가 많음
- 이러한 현재의 문제점들은 단기간에는 어려우나 장기적 관점에서는 모두 충분히 개선될 수 있음
- 인공지능의 장점
- 신약개발단계 별 인공지능 활용
- 신약개발단계
- 신약개발을 위해서는 여러 단계를 거치게 되는데 주로 연구단계와 개발단계로 나뉨
- 연구단계에서는 새로운 약물이 될 타겟을 탐색하는데 중점을 두며 다음과 원천기술연구들 같은 세부단계가 있음
- 목적효능 및 작용기전과 같은 의약학적인 개발목표를 설정하고, 발굴된 새로운 약물의 설계, 합성, 효능 및 독성 검색 연구를 반복하여 개발대상 물질을 선정함
- 개발단계는 최종 선별된 대상물질에 대한 주로 제조 및 임상실험을 하며 다음과 같은 세부단계가 있음
- 대량제조를 위한 공정개발, 제제화 연구, 부작용 및 독성에 관한 안전성평가, 생체 내 동태규명, 전임상(비임상)시험 및 임상시험, 신약 허가 및 시판 등
- 인공지능과 신약개발단계
- 인공지능은 신약개발의 모든 단계에 적용되고 활용 가능함
- 특히 연구개발 단계에서는 주어진 데이터 안에서 생물학적 표현형이 나타나는 원인을 추적하여 밝혀내는 등 새로운 생물학적 의약학적인 발견을 주로 이룸
- 이런 의생물학적 연구를 통해 새로 발견된 신약타겟물질들을 최적화된 화학적 설계를 하는 분야에도 적용됨
- 또한 Bench-to-Bedside 라고 흔히 일컬어 지는 translation을 가속화 시킬 수 있음
- 예를 들면 수천개의 가능성이 높은 물질들을 설계하고 테스트하여 성공률과 실패률을 지속적으로 축적 시킴으로써 추후 정확도가 향상된 예측을 가능케 함
- 이러한 실례들은 이미 여러 제약연구관련 회사들이 수행하고 있으며 주로 다음과 같은 방식으로 진행함
- 수십조개의 분자들을 수천개의 수학모델로 계산하여 수십년이 걸릴 연산을 수일에 cloud computing을 통해 수행함
- 이 과정에서 공개된 모든 의학적, 화학적, 생물학적 데이터들을 모두 이용함
- 약학적 주요 요인들을 이용하여 수학모델을 최적화 시키고 연산시간을 감소시킴
- cloud computing을 이용하여 수만개 이상의 CPU core를 사용함
- 수십개의 약물개발프로그램을 통한 검증을 반복함
- 이러한 과정을 거쳐 first-in-class인 disease-modifying drug을 개발할 수 있음
- 인공지능은 신약개발의 모든 단계에 적용되고 활용 가능함
- 신약개발단계
- 향후 전망
- 공동연구 증가 및 다각화 시도
- 각 기관들간 공동연구, 특히 산업계와 학계간 공동연구 증가 추세가 이어질 듯
- 대부분의 선진국들의 국책방향과도 일치하여 정부 혹은 정부출연기관들의 지원이 추가적 지원이 증가될 것으로 예상됨
- 이는 연구비 증가, 인력 교류 및 양성의 기회 증가, 공동연구를 위한 데이터 공유 기회 증가에도 긍정적 영향을 줄 것으로 기대됨
- 연구비 증가 추세
- 최근 몇년간의 인공지능에 대한 지나침 기대감의 상승세는 지속되지는 않고 일조의 조정 기간에 들어갈 것으로 보임
- 그러나 앞서 언급한 공동연구 증가와 다각화 시도에 따른 연구비 투자의 증가세는 지속될 것으로 예견되며 이로 인한 연구 기회 증가 추세 역시 지속될 것으로 보임
- 인력 교류 및 양성
- 바이오신약개발분야는 이미 매우 전문적으로 특화된 분야이며 여기에 적용되는 인공지능은 전문적으로 훈련된 인력에 의해 설계되어야 함
- 현재 인공지능은 물론 바이오인포메틱스 전반에 인력난은 매우 극심한 상황임
- 이에 따라 BT와 IT를 융합하여 교육시키고 훈련시킬 수 있는 다양한 학위과정이나 장단기 교육프로그램 개발이 증가할 것으로 예상 됨
- 또한 최첨단 융합학문 중 하나인 바이오인포메틱스 분야가 선도적으로 발전되어 있는 국가에 파견 등의 방식으로 인력교류를 증가시킬 시도가 있을 것으로 보임
- 바이오메디컬 데이터 공유 활성화
- 큰 기대감을 받고 있는 인공지능이 더욱 성공적으로 발전하기 위해서 대량의 양질의 바이오메이컬 데이터가 필수적임
- 시퀀싱 기술의 비약적 발전과 데이터 저장과 컴퓨터 연산 비용의 급감에 힘입어 바이오메디컬 데이터의 생산량이 급증하고 있으나 아직까지는 타 분야에 비하여 여전히 고비용이 들며 축적된 데이터의 수량 역시 부족한 현실임
- 공동연구기관들이나 컨소시엄 소속 기관들 간의 데이터 공유를 통하여 양과 질을 즉시 향상시킬 수 있어 현실적 대안책으로 부상할 것으로 보임
- 활용 분야의 다양화
- 인공지능은 기존까지는 주로 약물의 구조 예측 등에 국한되어 사용됨
- 유전체분석에 활용하거나, 약물의 부작용을 예측하거나, 임상단계의 데이터 분석에 활용되는 등 다양화되는 추세가 뚜렷함
- 결과 검증 강화
- 기존까지는 주로 인공지능이 발견하거나 예측한 결과에 대한 검증을 충분치 않게 하거나 실시 하더라도 다른 인공지능을 이용하거나 컴퓨터 시뮬레이션 등으로 비교분석 방식을 통하여 실시해 옴
- 그러나 바이오신약개발분야에서는 가장 이상적으로는 인체 상 실험을 하는 것이지만 윤리적 현실적인 어려움이 있어 동물이나 세포 상에서 생물학 실험을 통한 결과 검증이 반드시 요구됨
- 아직까지는 바이오신약개발연구에 있어 인공지능이 활용되는 초기단계 였으며 또한 인공지능이 가져올 파급력에 대한 기대감에 묻혀 결과 검증이 상대적으로 미흡 했었으나 향후에는 매우 엄격한 체계화된 검증이 강화될 것으로 예측됨
- 성능 향상
- 인공지능은 대용량 데이터를 충분히 학습하여 독자적 판단과 예측을 하기 때문에 학습과정에서 사용되는 데이터가 중요함
- 그러나 단지 초기에 학습을 시키는 과정만 중요한 것이 아니고 오히려 인공지능이 어떠한 판단을 해서 결과를 도출한 후에 이에 대한 피드백을 주어 도출한 결과가 옳은지 그른지를 다시 학습시키는 반복적 과정이 더욱 중요함
- 앞서 언급한 결과 검증 강화를 통하여 보다 중요한 반복적 재학습이 가능해 질 것으로 기대됨
- 특히 다른 컴퓨터시뮬레이션 등의 가상 검증이 아닌 실제 생물학 실험을 통한 매우 정확하고 의미있는 검증이 재학습 과정에 피드백으로 입력되어 진다면 인공지능의 정확도와 성능은 비약적으로 향상될 것으로 기대됨
- 공동연구 증가 및 다각화 시도
3 정밀의학
- 정밀의학에 대한 일반론
- 개념
- 정밀의학은 각 개인별 지내고 있는 유전자는 물론 환경 요인들의 차이점들을 파악하여 질병의 예방과 치료에 활용하는 새로 각광받고 있는 의료법임
- 정밀의학은 Precision medicine으로 불리며 보다 치료 단계에 주안점을 두어 생성된 개념인 Personalised medicine (맞춤의학)과도 같은 개념으로 통용되는 것이 일반적임
- 과학적 근거
- 질환 유발의 가장 근원은 바로 유전자 임
- 이 유전자 변이는 원인도 되지만 결국에 치료법이 실제 치유하는 효과를 가져올 수 있는지를 가늠하는 가장 중요한 요소임
- 가령 같은 암질환을 갖고 있는 어떤 환자는 A치료법이 잘 들어서 완치가 되는데 다른 환자에게는 A치료법은 전혀 효과가 없고 B치료법이 더 잘 맞기도 하는 현상은 매우 빈번히 관찰되고 있음
- 이런 원인을 파악하고 해결 할 수 있다고 기대를 모으고 있은 새로운 연구분야가 바로 Personalised medicine 혹은 Precision medicine이라 불리는 정밀의학 임
- 정밀의학이 최근에 급부상 하고 있는 이유는 다음과 같음
- 인간 유전체 시퀀싱 데이터의 급증
- 시퀀싱 데이터 저장 및 분석 기법 발달
- 인공지능과 같이 대용량 데이터를 요구하는 새로운 컴퓨터 분석기법들의 발달
- 개념
- Precision medicine initiative
- 미국 정부에서 발족한 Precision medicine initiative는 정밀의학 개념을 실제 임상의료에 적용하기 위한 과학적 발견에 집중 함
- 단기 목표
- 우선 암 치료를 위한 정밀의학 분야에 모든 노력을 기울이고 있음
- 성인 및 아동 암환자들을 위한 선택적 약물을 사용하는 혁신적 임상실험 시행
- 여러 암치료법의 장점들을 취한 복합적 치료법 활용
- 약물 만성을 극복하기 위한 지식데이터베이스 활용
- 장기 목표
- 백만명 이상 환자군 모집을 통한 연구 혁신
- 유전자 정보, 생체 샘플, 식이패턴 및 생활패턴 정보, 전자건강기록(EHR, Electronic Health Record)
- 차세대 과학을 위한 새로운 패러다임 제공
- 환자들의 참여 확대, 안정적인 데이터 공유, 개인정보보호 강화
- 이러한 환자군으로 부터 수집된 데이터는 연구에 활용
- 선진화된 의약유전체학연구, 정확히 요구되는 약물을 정확한 환자에게 최적기에 최적량으로 투여할 수 있음
- 질병의 예방과 치료를 위한 새로운 약물 후보 물질 발굴
- 생체정보패턴을 휴대기기를 통하여 수집하고 파악하는 접근
- 다른 질병들로의 적용 확대 방안 강구
- 백만명 이상 환자군 모집을 통한 연구 혁신
- 바이오신약개발분야에 있어 정밀의학
- 기존의 신약개발의 한계
- 동일 질병에 걸린 환자군에 대해 단일 약물이 동일한 효과를 보이지 못함 [3]
- 주요 질병군에 있어 특정 약물이 환자군에서 효능이 없는 비율을 보면 다음과 같음
- 천식 40%, 당뇨 43%, 관절염 50%, 치매 70%, 암 75%
- 특히 암의 경우 매우 저조한 편으로 이는 곧 같은 종류의 암을 보유하고 있더라도 각 개개인 별로 정확히 맞춤형으로 제작된 약물이 필요함을 보여줌
- 암 질환이 개개인별 유전자 특성을 고려해야만 하는 이유는 대부분의 암세포의 변이가 유전자의 변이로 부터 기인하기 때문임
- 특정 약물로 유전자 변이를 타겟하여 치료할 가능성을 각 암 종류별 나열함
- Melanoma 73%, Thyroid 56%, Colorectal 51%, Endometrial 43%, Lung 41%, Pancreatic 41%, Breast 32%, Head and neck 21%
- 정밀의학에 기반한 새로운 방식의 신약개발 (Figure 1)
- 기존의 신약개발 방식
- 정밀의학에 기반하지 않고 개인별 다양한 유전적 특성을 지닌 전체 환자군을 대상으로 단일 약물을 개발
- 개인별 유전적 다양성이 고려되지 않고 투여된 약물은 일부 환자들에게는 효능이 있으나 나머지 환자들에게는 효능이 없거나 부작용이 발생
- 정밀의학을 활용한 신약개발 방식
- 바이오마커 진단을 통하여 개인별 다양한 유전적 특성을 지니는 환자들을 특정 그룹으로 분류함
- 시장에 나와있는 유전자 테스트 상품은2016년 기준 6만 5천여개로 10여년간 3배 가량 성장함[4]
- 분류된 각 그룹별 유전적 특성에 기반한 맞춤형 약물을 각 그룹별로 개발
- 유전자 변이와 그로 인해 나타나는 표현형이나 질병과의 연관성이 밝혀진 유전자 개수는 2015년 기준으로 2,937개로 10년간 2배 증가[4]
- 약물들 중 바이오마커 정보가 있는 경우는 2015년 기준으로 132건으로 10년간 3배 이상 증가 함[5]
- (다) 각 환자 그룹별로 맞춤 제작된 약물을 투여함으로써 부작용 없이 모든 환자에게 우수한 효능을 보증할 수 있음
- 바이오마커 진단을 통하여 개인별 다양한 유전적 특성을 지니는 환자들을 특정 그룹으로 분류함
- 기존의 신약개발 방식
- 기존의 신약개발의 한계
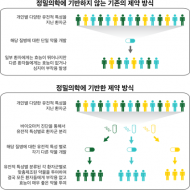
| Figure 1 기존 신약개발 방식과 정밀의학에 기반한 새로운 신약개발 방식 비교 |
- 정밀의학 활용 추세
- 2008년 이래로 정밀의학 활용은 지속적인 증가세
- 각 연도별 정밀의학 활용 빈도는 다음과 같음[6]
- 08년 5건, 10년 36건, 12년 81건, 14년 106건, 16년 132건
- 08년 대비 16년에는 26배 증가
- 정밀의학의 최근 급증은 유전자 테스트 기법의 발달에 기인함
- 15년도 4월 부터 16년도 9월 사이에 5,500여건의 새로운 유전자 테스트 상품이 개발되고 시장에 런칭됨[7] 특히 15년도 4월 대비 16년도 9월을 비교하면 4배 가량 증가됨
- 제약산업업계에서 정밀의학을 활용 급증[8]
- 정밀의학에 기반한 신약개발 급증
- 2015년 기준으로 모든 신약개발 파이프라인에 42%가 정밀의학에 기반
- 그중에 73%가 암 질환 관련한 약물개발임
- 향후 5년간 정밀의학에 기반한 신약개발 파이프라인은 69% 증가할 것으로 예측되고 있음
- 정밀의학 활용을 위한 연구비 투자 급증
- 지난 5년간 정밀의학에 기반한 신약개발에 두배 넘는 연구비 투자가 있었음
- 향후 5년간 33% 가량 연구비 투자가 더 증가될 것으로 예측됨
- 정밀의학의 최근 급증은 유전체염기서열분석기법의 비용이 급감하는 것과도 깊은 연관성이 있음
- 바이오신약개발에 있어 정밀의학 활용에 난관
- 행정 및 정책상 난관
- 정밀의학은 최근에 급격히 발전하고 있는 분야여서 최신 과학실험기법들을 주로 사용하다 보니 기존 신약개발과 FDA 승인 등의 절차에서 사용되지 않던 새로운 사항들에 대한 규제정책 마련이 시급함
- 정밀의학이 환자들에게 실제로 적용되기 위해서 현실적으로 가장 중요한 것은 비용이므로 보험지급정책 마련 역시 시급함
- 행정과 정책적 문제점들은 본 보고서에서는 논외로 함
- 과학 및 임상단계 에서의 난관
- 과학적 기술적으로 최근 괄목할 만한 발전을 이루었으나 실제 임상에서 활용되기 위한 헬스케어시스템의 발전은 더딘 실정임
- 헬스케어시스템에 정밀의학이 정착하기 위해서는 다음과 같은 원칙들이 선행되어야 함
- 헬스케어 제공자, 지급자, 고용자, 정책입안자 및 환자들과 그 가족들이 정밀의학의 개념과 기술에 대해 보다 더 잘 이해를 해야함
- 개인의 생체정보를 사용하는 것에 대해 정보보호와 사생활 보호 등 법률적, 윤리적, 사회적 이슈들에 대한 정책과 집행에 대한 환자들이 충분히 이해를 한 후 동의하고 받아들일 수 있어야 함
- 정밀의학이 임상에서 실질적 장점이 있다는 것을 증명할 우수한 사례들을 수집하고 배포하는 최적의 방법론이 수립되어야 함
- 임상에서의 주요 결정에 도움을 줄 수 있도록 개인의 정보와 임상 정보가 포괄적이고 유익하고 용이하게 사용할 수 있는 데이터관리시스템과 같은 기반시설이 요구됨
- 개인별 맞춤의학이 실질적으로 사용가능하게 해줄 수 있는 최상의 헬스케어 접근법, 절차, 운영체계가 갖추어져야 함
- 행정 및 정책상 난관
- 정밀의학에 기반한 신약개발 급증
- 향후 전망
- 인공지능 활용 급증
- 헬스케어 분야에서 인공지능을 활용하여 절감 할 수 있는 비용 2025년 기준으로 미화 450억달러 (대략 한화 48조원)에 이를 것으로 예상[14]
- 헬스케어 분야에서 인공지능 산업의 증가세는 가파를 것으로 예상됨[15] [16]
- 2016년 미화 7억 달러, 2022년 미화 80억 달러, 2024년 미화 100억 달러 이상으로 40%가량 성장이 예상됨
- 인공지능 헬스케어 산업 규모는 크게 둘로 나뉠 것으로 전망됨 (2024년)
- Intelligent Diagnostics: 정확한 진단을 통해 정밀의학 구현에도 기여
- Drug Discovery: 신약 개발의 여러 난관 해결에 기여
- 인공지능 헬스케어 산업이 급성장하는 주요 원인은 정밀의학을 포함하여 다음과 같음
- 정밀의학을 위한 인공지능 활용이 지속적으로 요구되고 있음
- 헬스케어 연구분야에 인공지능 도입
- 인공지능이 적용되고 활용될 분야가 매우 다양하고 확대되고 있음
- 인공지능의 활용으로 노동시간의 단축 및 환자 케어의 질을 향상 시킴
- 다양한 산업계간 파트너쉽 체결이 증가하고 있음
- 환자들을 케어할 의료업계 종사자들의 수가 급감하고 있음
- 헬스케어 비용을 절감하기 위한 요구가 지속적으로 증가 하고 있음
- 정밀의학을 위한 헬스케어 시스템 보완
- 임상에서 정밀의학이 실제로 활용되어 개선된 의료가 제공되기 위해서 헬스케어 정책 및 규제 방안 등이 보완될 것으로 예상됨
- 정밀의학의 활용이 초기 단계인 만큼 환자들의 의료비 부담을 해소시키기 위한 보험정책들이 추가 보완될 것으로 예상됨
- 임상의사들과 환자들이 정밀의학에 대한 올바른 이해와 활용을 할 수 있도록 켐페인과 설명회 등의 다양한 기회가 제공될 것으로 예상됨
- 인공지능 활용 급증
4 결론
- 바이오신약개발 연구 현황
- 최근 들어 늘어나고 있는 문제점들
- 장기간에 걸친 지속적 고비용 연구비 투자가 요구되는 분야
- 다양한 경제적 요인들로 인하여 투자 되어야할 연구 비용이 급증하고 있음
- 신약물질 발굴이 어려워 지는 등의 이유로 성공률 또한 급락하고 있음
- 문제점 해결을 위한 새로운 시도
- 연구개발기간 단축을 통한 연구비 투자금액을 줄이고 성공률을 개선시키기 위한 다양한 시도들이 이루어 지고 있음
- 인공지능
- 최근 가장 주목받고 있는 새로운 방법론이 인공지능을 활용하는 것임
- 새로운 신약물질을 발굴하며, 가급적 초기에 발굴 약물의 효능 및 부작용 예측을 통하여 성공여부를 판가름 하는 등의 새로운 연구 방식이 등장함
- 정밀의학
- 인공지능과 함께 최근 급부상하고 있는 분야는 정밀의학 임
- 최근 급속도로 발전한 유전체염기서열분석기법 등의 최신 분자생물학 실험기법들에 힘입어 환자 개인별 유전체 정보 및 바이오마커 정보 등의 분석이 가능해 짐
- 동일한 질병을 보유하더라도 환자 개인별 특이성에 기인한 약물 효능 저하 및 부작용을 미연에 방지하고 최적의 치료 약물을 최적의 시점에 최적의 투여량만 처방이 가능함
- 최근 들어 늘어나고 있는 문제점들
- 바이오신약개발 연구 향후 전망
- 개방형 혁신(Open Innovation)
- 바이오신약개발 연구에서 주로 초기 신약발굴 단계에서 선-경쟁(precompetitive)한 연구들을 공동으로 진행하는 흐름이 확산될 것으로 보임
- 개방형 혁신을 통하여 산-학-연-병 공동연구가 급증할 것으로 예측됨
- 여러 기관들 간의 공동연구 뿐 아니라 다양한 연구분야들 간의 융합 연구 역시 급증할 것으로 보임
- 개방형 혁신에서 핵심적인 사항은 각 기관별 보유한 데이터를 서로 공유함으로써 진정한 빅데이터 구축을 통한 새로운 연구가 활성화 될 것으로 전망됨
- 인공지능
- 바이오신약개발이나 정밀의학 등에 인공지능을 활용하는 바이오메디컬 분야와 컴퓨터공학 분야의 융합이 더욱 활성화 될 것으로 보임
- 개방형 혁신을 통한 데이터 공유가 활성화 되어 빅데이터가 구축됨으로써 인공지능의 성능과 정확도를 향상시킬 수 있을 것으로 기대됨
- 세분화 되고 다단계로 이루어진 바이오신약개발공정에서 더욱 다양한 단계에서 인공지능이 활용될 것으로 전망됨
- 개방형 혁신(Open Innovation)
5 참고문헌
- Harrison RK: Phase II and phase III failures: 2013-2015. Nat Rev Drug Discov 2016, 15(12):817-818.
- Cook D, Brown D, Alexander R, March R, Morgan P, Satterthwaite G, Pangalos MN: Lessons learned from the fate of AstraZeneca's drug pipeline: a five-dimensional framework. Nat Rev Drug Discov 2014, 13(6):419-431.
- Spear BB, Heath-Chiozzi M, Huff J: Clinical application of pharmacogenetics. Trends Mol Med 2001, 7(5):201-204.
- Chong JX, Buckingham KJ, Jhangiani SN, Boehm C, Sobreira N, Smith JD, Harrell TM, McMillin MJ, Wiszniewski W, Gambin T et al: The Genetic Basis of Mendelian Phenotypes: Discoveries, Challenges, and Opportunities. Am J Hum Genet 2015, 97(2):199-215.
[1] Boston Consulting Group
[2] Boston Consulting Group
[3] CB Insights
[4] Concert Genetics. Available at concertgenetics.com
[5] Personalized Medicine Coalition
[6] Personalized Medicine Coalition
[7] Concert Genetics
[8] Tufts Center for the Study of Drug Development
[9] Quantitative Advances Since the Human Genome Project (HGP), National Human Genome Research Institute.
[10] myGenome, Veritas Genetics
[11] Quantitative Advances Since the Human Genome Project (HGP), National Human Genome Research Institute.
[12] Quantitative Advances Since the Human Genome Project (HGP), National Human Genome Research Institute.
[13] Regalado, A. EmTech: Illumina says 228,000 human genomes will be sequenced this year. MIT Technology Review. September 24
[14] Goldman Sachs, “Profiles in Innovation: AI” (2016)
[15] Global Market Insights, “Healthcare AI Market Size, Competitive Market Share & Forecast, 2024” (2017)
[16] Centers for Medicare and Medicaid Services, Office of the Actuary, National Health Statistics Group; US Department of Commerce, Bureau of Economic Analysis; and National Bureau of Economic Research Inc.


